Healthcare Report 2019.1.27
Healthcare Report 2019.1.27 (医療機器・医薬品上市申請)
(中日文译)
2019年1月27日、NPO法人Healthcare Association(医博会)在东京理科大学举行了医療機器・医薬品上市申請講演。
【早期がんのスクリーニング用検査薬と医療機器の開発】
講演者:神奈川大学 張 善俊 教授
2013 年の国立がん研究センターのデータによって、国民平均寿命は長い日本において、 がん発生率はおおよそ 50%であった。年間約 101 万人は新たにがんに罹患してしまう。 発生率の高い順に男性においては胃がん・肺がん・大腸がん、女性においては乳がん・ 大腸がん・胃がんである。 がん細胞は、正常の細胞の遺伝子を傷がつくことによって、発生する。一つの細胞は徐々 にがん化誘発され、自体の免疫修復機能とかん細胞の増殖を戦い、臨床上で検査でき るサイズ(1cm3)になるまで 10 年から数十年必要である(10~30 年) 。 従来とおりの早期がん検査手段の欠点:(PET-CT・内視鏡等) 正確率の限度がある 検査費用が高い 、検査時間がかかる、精神や体への負担が多い。
中译 : 根据 2013 年国立癌症研究所的数据显示, 在长寿之国日本, 癌症发生率约为 50%; 每年新增癌症患者 101 万人。按 癌症发生率由高到低排列 : 男士为 胃癌 , 肺癌 , 大肠癌 ; 女士为 乳腺癌 ,大肠癌 ,胃癌 。癌症细胞是由于正常细胞的遗传物质受损 后演化生成。细胞在被诱发癌变后, 经过 机体的免疫修复 机能 和癌细胞增殖机制的相互作用 ,直至生长 到 能通过临床手段检测出来的大小( 1 cm 3 ) , 需要 10 年 到 数 十 年 的 时 间 。( 10 – 30 年 )。 目前为止的癌症早期诊断方法的缺点 : ( PET – CT/ 内窥镜等) 准确率有限;检查费用高昂;检查时间长;对患者精神和身体上的负担重。
一方、Noah (Non-invasive Once-risk Assessment for Healthcare)という早期がんスクリ ーニング評価方法は、尿液中のがん細胞の特有の代謝物と酸化 DNA の代謝物との測定に より、がんの罹患リスクをスクリーニングする非侵襲手法である。 Noah 早期がんスクリーニングの原理: ALA という物質は、正常細胞では蛍光を認めないヘムに速やかに代謝されるが、が ん細胞中のミトコンドリアの活性が低いため、ポロトポルフィリンが選択的に蓄積さ
れ、さらに尿中に排泄される。ポルフィリンは青光に照射されると赤光が現れる。こ の現象によって、体内にがん組織の有無をスクリーニングすることが可能になる。老化や炎症化・癌化される細胞では、DNA などの物質への酸化ダメージからの正常の状態に戻る修復能力が劣る。その中、酸化の影響を受け、遺伝子物質の構成原料 dG が損傷しやすく、その後 8-OHdG に代謝されて、尿液に排泄する。 Noah 早期がんスクリーニングのとき、受診者の尿液検査を通して、がんの罹患リスクを 格付けで評価する。
中译 : 同时, Noah (非侵袭一次风险评估方法)作为一种早期癌症筛查方法,是通过测定尿液 中的癌细胞特有代谢物和氧化损伤 DNA 代谢物,进行癌症罹患风险筛查的一种非侵袭检 测手法。Noah 早期癌症筛查的原理 : ALA 这种物质,在正常细胞中会被代谢生成不发生荧光反应的血红素, 但是由于癌细 胞的线粒体的活性较低, 中间代谢产物 原卟啉会被选择性的蓄积 , 然后通过尿液排泄到体外。 由于 卟啉在蓝光照射下会显示红色,利用这个 原理 ,将筛查体内有无癌细胞变为可能。在老化或者有炎症或发生癌变的细胞中, DNA 等物质从氧化损伤中 修复回 正常状态的能力减弱。其中,受到氧化影响,作为 遗传 物质的合成原料的 dG 很易受损,最后衍生 代谢成 8 – OHdG, 随尿液排出。 Noah 早期癌症诊断时,通过检查受试者的尿液,对患癌风险进行评级评估。
【医療機器の開発から上市までの審査及び政策】
講演者:国立医薬品食品衛生研究所 岡本 吉弘 室長
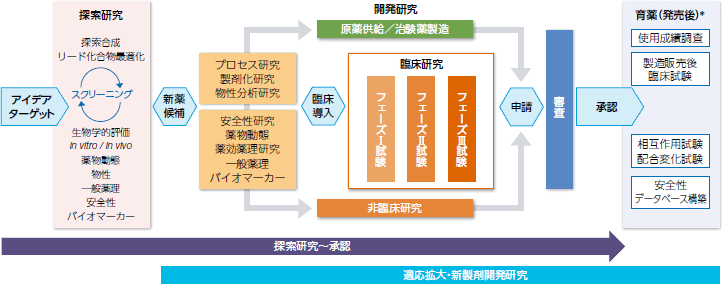
人もしくは動物の疾病の診断、治療、もしくは予防に使用されること、または人若しくは動物の身体の構造若しくは機能に影響を及ぼすことが目的とされている機械器具等であって、政令で定めるものは薬事法上では医療機器と呼ばれる。医薬品の場合において共通の評価方法は存在するが、医療機器は製品のリスク・ベネフィットの視点に基づき 個別に判断し適切な評価方法で検証する。
中译 : 用于人体或动物的疾病的诊断,治疗或预防时使用的器材或 者对人或动物的身体结构或 机能产生影响且在 政令规定范围内的器材,在药事法上被定义为医疗器材。与存在共通的评价方法的医药品相比, 医疗器材依据产品的风险和收益进行个别判断并采用与之相应的评价方法进行验证。(图 : 依据风险 的医疗器材 分类 )・承認品目の該当機器に対して、品目ごとにその製造販売についての厚生労働大臣の承認を受けるため、下記の条件を満たさなければならない。 製造販売業の許可 製造業の区分ごとの登録 効果または性能を有することかつ効果又は性能に比べ著しく有害な作用を有するこ とにより医療機器として使用価値がないと認められないこと。 製造管理または品質管理の方法が、厚生労働省令で定める基準に適合している
中 译 : 针对 需要承 认许 可申 请 的医 疗 器材, 为 了得到每个 产 品的厚生 劳动 大臣 颁发 的制造和 销 售的 许 可,需要 满 足下列条件。 制造 销 售从 业 的 许 可;依制造内容分 类进 行的登 记 ;器材本身要有效并且其安全性方面器材的使用价 值 要高于它的潜在 风险 危害 ; 医疗器材的制造管理和品质管理的方法需要 满足厚生劳动省的法令基准(即满足 QMS 省令要求)
申請の際にその他の非臨床試験及び臨床試験の注意点など例として挙げながら説明を頂きました。最後に、総合討論で、皆様から様々な問題に対し、答えを頂きました。ご興味のある方は事務局までご連絡ください。(info.healthcare.assoc@gmail.com)
中译:讲演也列举了 申请用非临床与临床试验的注意点。最后在长达40分钟的综合讨论中,针对参加者的各种各样问题,讲师做了解答。对以上内容有兴趣和想咨询的朋友请联络事务局。(info.healthcare.assoc@gmail.com)